服务中心
CUSTOMER SERVICE
随着全球老龄化加剧,关节置换手术量激增,但假体周围骨溶解(Periprosthetic Osteolysis, PPO) 导致的无菌性松动(Aseptic Prosthesis Loosening, APL) 成为术后首要并发症。📊研究显示:38.7%的膝关节翻修 和 49.2%的髋关节翻修 由APL引发。
其核心病理机制是:人工关节磨损产生的钛金属等颗粒诱导局部巨噬细胞发生焦亡,释放 IL-1β、IL-18 等炎症因子,激活 RANK-RANKL 信号通路,最终导致破骨细胞过度活化与骨组织吸收。
近期,浙江大学医学院附属第一医院骨科团队在《Journal of Extracellular Vesicles》发表了一项突破性研究,他们创新性地构建了一种由M₂巨噬细胞(抗炎表型)和人脐带间充质干细胞(hucMSC)融合而成的外泌体(fEV),成功实现了对假体周围巨噬细胞焦亡的靶向调控,为预防和治疗PPO提供了新策略。研究中,层浪流式细胞仪LongCyte®在关键环节发挥了重要的验证作用。下面,让我们深入了解这项研究的主要内容:
为明确假体周围骨溶解的病理机制,研究对比分析了患者组织样本:以初次置换患者的滑膜组织(SM) 为对照,收集了因无菌性松动导致骨溶解患者的假体周围膜组织(PM)。
H&E染色揭示两者显著差异:PM组织呈现结构紊乱,并伴有显著的炎症细胞浸润,这是骨溶解的典型病理改变(图1)。
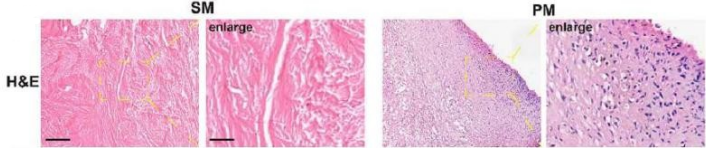 图1
图1

进一步探究发现,PM组织存在强烈的巨噬细胞焦亡现象:
1. 免疫组化显示,PM炎症区域的焦亡执行蛋白GSDMD表达显著高于SM组织(图2)。
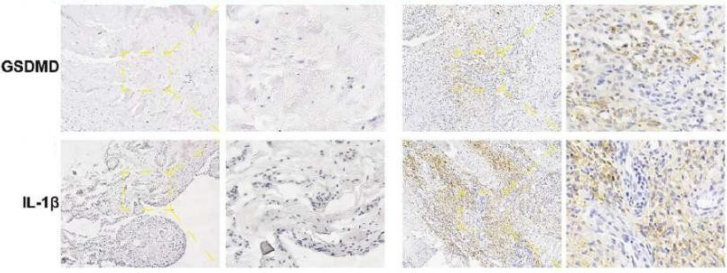 图2
图2
2. PM组织中促炎因子IL-1β的阳性区域面积更是SM组织的约15倍(P<0.001),表明焦亡相关因子大量释放。

结论: 这些发现共同表明,持续的炎症微环境和巨噬细胞焦亡的激活是假体周围膜(PM)的核心病理特征,它们共同介导了磨损颗粒引发的炎症级联反应和病理性骨吸收过程。

为精准递送治疗性囊泡至骨溶解区域,本研究创新性地融合了两种功能性细胞外囊泡(sEV):
1.M₂-EV:源自经IL-4 (20 ng/mL) 和 IL-13 (10 ng/mL) 诱导48小时的M2型巨噬细胞(极化效率经层浪生物流式细胞仪检测CD206表达证实,图3),具备天然炎症靶向能力。
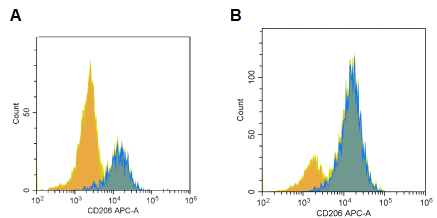
图3
2.hucMSC-EV:源自人脐带间充质干细胞,具有抗炎与骨代谢调控潜能。

通过超速离心法分离获得两种sEV后,利用融合技术构建了融合囊泡 (fEV)。其成功制备与特性通过以下关键实验确证:
1.高效融合验证(流式核心):
a.分别用DiI(红)标记M₂-EV,DiO(绿)标记hucMSC-EV。
b. 流式细胞仪 (LongCyte®)检测显示,当两种EV以 1:1比例融合时,双阳性 (DiI⁺DiO⁺) 颗粒比例高达约 35.96%(图4),显著高于单纯物理混合组,证明有效膜融合发生。
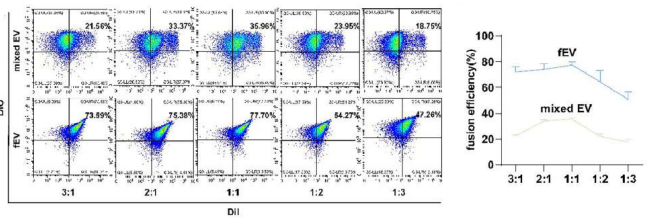
图4.流式分析:
不同比例 M₂-EV 和 hucMSC-EV 融合情况的结果
🔺点击图片了解更多LongCyte®详情
2.物理特性表征:
a.透射电镜 (TEM):原始EV呈碟形(~100-120 nm),而fEV呈形态完整且粒径更均一(~50 nm)的囊泡,利于组织穿透。
b.激光共聚焦显微镜:fEV组红绿荧光信号完全共定位,而混合组信号分离,直观证实融合成功并整合了双亲本特性。

结论: 流式双阳性定量与形态学共定位结果一致,共同确证了兼具M₂-EV靶向性与hucMSC-EV治疗活性的fEV的成功构建。

fEV体外抑制巨噬细胞焦亡
为评估fEV的抗焦亡作用,研究在LPS预刺激+钛颗粒诱导的BMDM焦亡模型中进行体外实验。关键发现如下:
1.保护细胞存活:活/死染色与LDH释放检测显示,fEV及混合EV能显著逆转钛颗粒诱导的细胞死亡,而单独使用M₂-EV或hucMSC-EV效果有限。
2.抑制焦亡起始信号:fEV及混合EV干预显著减弱了LPS+钛颗粒诱导的ASC斑点形成(焦亡关键起始步骤)。
3.下调焦亡关键蛋白:Western Blot分析表明,fEV及混合EV处理组细胞裂解物中,焦亡执行蛋白 caspase-1 p20、GSDMD-NT 及成熟IL-1β p17 的表达水平均明显降低。
4.减少炎性因子释放:细胞上清液分析证实,fEV及混合EV能有效抑制LPS+钛颗粒诱导的IL-1β 和 IL-18 释放。

结论: fEV与混合EV在体外模型中展现出相近且显著的巨噬细胞焦亡抑制作用,效果远超单独使用任一种亲本EV。这突显了M₂-EV与hucMSC-EV成分在功能上的协同效应。

fEV双向调节骨代谢
体外研究揭示了 fEV 在调节骨代谢平衡中的关键作用:
1.抑制巨噬细胞破骨分化:
a.早期信号抑制:fEV 显著降低 RANKL 诱导的巨噬细胞 ROS 生成(破骨分化关键启动信号)。
b.抑制成熟破骨细胞形成:TRAP 染色显示 fEV 及混合 EV 显著减少破骨细胞数量。
c.下调破骨关键蛋白:Western Blot 证实 fEV 显著抑制 NFATc-1、TRAP 和 CTSK 蛋白表达。这些结果共同证明 fEV 有效阻断了巨噬细胞向破骨细胞的分化与成熟。
2.促进 hBMSC 成骨分化:
a.增强成骨标志物:ALP 染色、茜素红 S (ARS) 染色和天狼星红染色一致显示,fEV 及混合 EV 处理 显著增强 hBMSC 的 ALP 活性、钙结节形成和胶原沉积,定量分析进一步证实。
b.上调成骨关键转录因子:Western Blot 表明 fEV 及混合 EV 组 RUNX2 和 Osterix 蛋白表达水平显著高于单 EV 处理组,证明其更强效地促进了成骨分化。

fEV体外抑制巨噬细胞焦亡
在钛颗粒诱导的小鼠颅骨骨溶解模型中,fEV 展现出卓越的体内靶向性和治疗效果:
1.精准靶向骨溶解区域:
a.活体成像 (IVIS):DIR 标记的 fEV 在尾静脉注射后 24 小时于骨溶解区域达到峰值富集,其荧光强度显著高于 hucMSC-EV 组(约 3 倍,P<0.001)和混合 EV 组(约 2.2 倍,P<0.001),证明融合技术(非单纯混合) 是实现高效靶向递送的关键。
b.器官分布:fEV 在肝脾有残留,提示其延长了体内循环时间。
2.显著防治骨溶解:
a.Micro-CT:fEV 治疗显著改善了钛颗粒引起的骨破坏,表现为增加 BV/TV(骨量)、降低 BS/BV(骨表面密度) 和总孔隙率,效果优于单 EV 组。
b.组织学验证:
i. H&E 染色:fEV 减轻炎症浸润,恢复骨组织形态。
ii. TRAP 染色:fEV 显著减少骨溶解区破骨细胞数量。
iii. 免疫荧光:fEV 增强成骨标志蛋白 RUNX2 表达,促进骨修复。
3.靶向抑制病灶区巨噬细胞焦亡:
a.免疫荧光证实,fEV 能显著降低骨溶解区域焦亡执行蛋白 GSDMD 和效应因子 IL-1β 的表达水平,效果优于混合 EV 及单 EV 组。

结论: fEV 凭借其主动靶向病灶能力和整合的治疗活性(抑制焦亡、调节骨代谢),在体内模型中实现了对假体周围骨溶解的高效防治。

本研究通过 M₂巨噬细胞和人脐带间充质干细胞来源的 EV 融合技术构建而成了兼具靶向性与治疗性的 fEV 平台,为假体周围骨溶解提供了 “精准抗焦亡 - 促进骨修复” 的双重治疗策略。尽管在机制解析与临床转化层面仍面临 fEV 对假体松动有效性的深入探索及人体疗效验证、免疫原性和伦理问题、体内安全性评估等挑战,但其创新的技术路径为细胞外囊泡在骨科领域的应用开辟了新方向,为 sEV 在医疗实践中的应用提供新的见解,有望开启再生医学的精准治疗新范式。
参考文献:
Liu, Q., et al. (2024). Fused extracellular vesicles from M2 macrophages and human umbilical cord mesenchymal stem cells for the targeted regulation of macrophage pyroptosis in periprosthetic osteolysis. Journal of Extracellular Vesicles, 13, e70028.